Drehmomente im Nanokosmos der Zelle: Dresdner Forscher dedektieren biophysikalische Kräfte von molekularen Motoren in 3D
28.05.2020
 B CUBE
B CUBE
Welche biophysikalischen Kräfte wirken während der Zellteilung? In einem koordinierten Vorgang wird das Erbgut auf zwei Tochterzellen aufgeteilt. Dabei spielen Motorproteine eine entscheidende Rolle: Sie sorgen dafür, dass Mikrotubuli zielgerichtet arbeiten. Diese winzigen Röhren bilden die Fasern des Spindelapparats. Motorproteine bewegen und quervernetzen die Mikrotubuli und sorgen für eine reibungslose Zellteilung.
Pressemitteilung der TU Dresden vom 28.05.2020:
Die Wissenschaft ging bisher davon aus, dass Motorproteine ausschließlich lineare Kräfte, parallel zur Richtung der länglichen Mikrotubuli erzeugen. Wissenschaftler*innen des B CUBE der TU Dresden haben jedoch gezeigt, dass sich bestimmte Kinesin-Motorproteine auch seitwärts bewegen. Ihre Studienergebnisse haben sie jetzt in Nature Communications veröffentlicht.
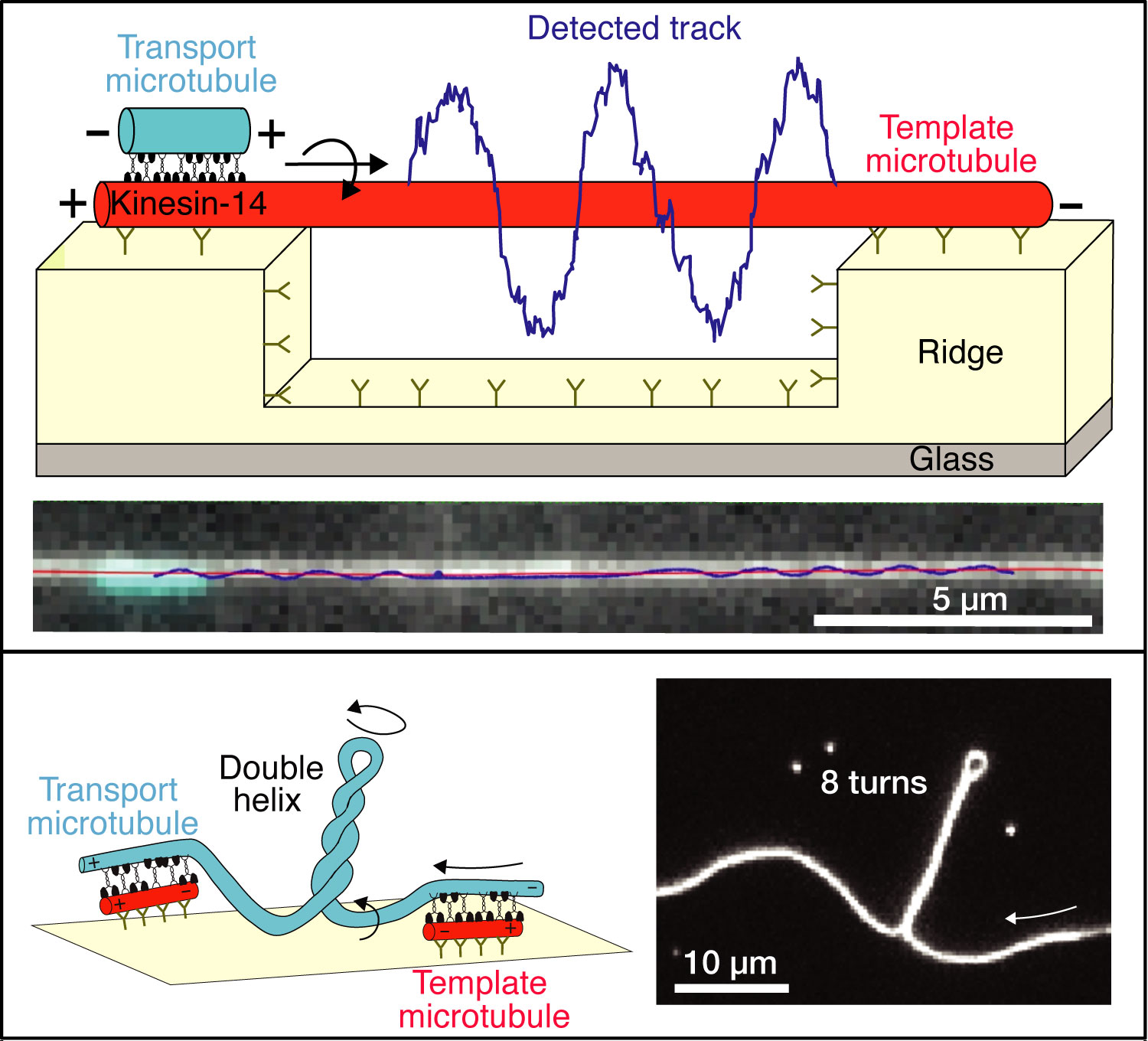
Für ihre Studie entwickelte das Team um Prof. Stefan Diez, das aus TUD und MPI-CBG Forschern besteht, einen neuartigen Experimentaufbau, mit dem die Seitwärtsbewegung der Motorproteine untersucht werden konnte. „In unserem dreidimensionalen Assay konnten wir zeigen, dass die Motoren die Mikrotubuli nicht nur vorwärts schieben, sondern auch deren helikale Bewegung hervorrufen. Wir nutzten in der CMCB Microstructure Facility eigens hergestellte Oberflächen mit Nanostrukturen und beobachteten, wie sich die Mikrotubuli spiralförmig um lange verankerte Mikrotubuli wanden. Eine weitere Erkenntnis unserer Experimente ist: Die Motorproteine erzeugen Rotationskräfte, die stark genug sind, um die ziemlich starren Mikrotubuli zu verbiegen und aufzuwinden. Dies erklärt das Phänomen der gewundenen Spindelarchitektur, die kürzlich in lebenden Zellen beobachtet wurde“, erklärt Prof. Stefan Diez, Senior-Autor der Studie.
Auch das Phänomen der Chiralität wird durch die Studie berührt: Chiraliät bedeutet, dass sich Strukturen nicht mit ihrem Spiegelbild zur Deckung bringen lassen. Sie ist das Kennzeichen des Symmetriebruchs während der zellulären Entwicklung, zu ihren Hintergründen ist bisher jedoch wenig bekannt. Nun wissen die Biophysiker: Chiralität kann durch die Rotationskräfte der Motorproteine erzeugt werden.
Veröffentlichung:
Nature Communications 11, 2565 (2020): „Kinesin – 14 motors drive a right-handed helical motion of antiparallel microtubules around each other“, Autoren: Aniruddha Mitra, Laura Meißner, Rojapriyadharshini Gandhimathi, Roman Renger, Felix Ruhnow, Stefan Diez